糖尿病・内分泌・免疫研究
時間生物学研究グループ
グループリーダー:
太田康晴、田口昭彦、秋山優
メンバー:
永尾優子、淀川拓馬、淀川千佳、藤岡侑香
体内時計に着目した病気の予防・治療
近年、生活習慣病と体内時計との関連が注目されています。例えば、夜間労働するシフトワーカーの方などは糖尿病の発症リスクが高まることが報告されています。この体内時計は専門的には概日リズムと呼ばれ、生物が地球の環境サイクルに適応するため、約24時間周期で変動する生理現象です。原核生物からヒトに至るあらゆる生物に見られるだけでなく、睡眠、摂食から細胞周期、代謝、生殖など基礎的な生命現象を制御しています。
私たちは海外旅行などで大陸を横断した際には時差ボケを悩まされ、自分たちの体にはリズムがあるということを体感できます。しかしながらどのようなメカニズムで概日リズム(体内時計)が生み出されるのか?長らくその理由は解明されていませんでした。1980年代に入り、概日リズムを生み出すために必要な遺伝子群(時計遺伝子)が発見され始め、そうした時計遺伝子群の働き(転写翻訳ネガティブフィードバック機構)によって、極めて正確なリズムが作り出されていることが分かりました。この発見に貢献した3人の研究者は2017年にノーベル生理学・医学賞を受賞しています。
私たちは、この概日リズムが制御する生体の機能を研究し、その結果をさまざま病気の治療や予防に生かしたいと考えています。
体内時計によるインスリン分泌調節に関する研究
私たちはインスリン分泌不全を伴って糖尿病を発症するマウスの単離ラ氏島(インスリンを出す組織)を用いた網羅的解析によって、膵臓が正常なインスリン分泌を行うためには時計遺伝子であるDBP及びE4BP4が重要ではないかと考えています。
出力系の時計遺伝子であるDBPとE4BP4の発現は、Bmal1やClockといったコア時計遺伝子によって調節されています。DBPとE4BP4はともにD-box(DBP や E4BP4 などが特異的に結合する DNA 領域のこと.DBP や E4BP4 が D-box に結合することで、関連する遺伝子が制御される)に結合しますが、互いに逆位相の日内リズムで変化し、DBPは転写を活性化し、E4BP4は転写を抑制します。膵β細胞(膵ラ氏島の中のインスリンを分泌する細胞)特異的にD-boxへの活性化シグナルが恒常的に阻害されているモデルマウスとして、我々はE4BP4を過剰発現するマウス(MIP-E4BP4 TG[トランスジェニック]マウス)を作製し、すでにその解析から得られた成果を報告しています(Ohta Y, et al., EbioMedicine, 2017)。このマウスがブドウ糖負荷後の著明なインスリン分泌の低下とそれに伴う耐糖能異常を呈していたことから、生体リズムの異常が糖尿病の発症進展に関与する際に、DBPを介したシグナルが極めて重要であることを解明しました。その機序についてはまだまだ不明な点が多いため、現在さらなる解析を行っています。
さらに全身型のDBP欠損マウスもすでに樹立し、このマウスを用いたインスリン分泌の解析も行なっており、ブドウ糖負荷試験、単離ラ氏島の培養で、ともにインスリン分泌不全を呈するという成果を出しつつあります。DBP欠損マウスの膵ラ氏島を用いた網羅的解析を行い、E4BP4過剰発現マウスの網羅的解析の結果を比較することにより、DBP、E4BP4のインスリン分泌における役割に関して新たな切り口を見出すことができると考えています。しかしながら全身型のDBP欠損マウスの場合には、肝臓や筋肉、脂肪細胞での表現系によって、インスリン分泌や糖代謝の表現系がマスクされてしまっている可能性もあるため、DBP欠損による膵β細胞特異的な効果を検証するためには、やはり膵β細胞特異的DBP欠損マウスの作製とその解析が不可欠と考えており、その作製も検討しています。
体内時計による肝臓での糖・脂質代謝調節に関する研究
MIP-E4BP4 TGマウスで明確な表現系が認められたことから、同様のシステムを肝細胞に応用し、E4BP4を過剰発現するTGマウスを作製しました。その中で10コピー組み込んだTG-Bマウスと100コピー組み込んだTG-Cマウスでは、インスリン負荷試験において顕著なインスリン抵抗性が認められました。肝臓の脂肪化についてはTG-Cではわずかに増加していたものの、TG-Bでは脂肪化の亢進が全く認められなかったため、脂肪化がインスリン抵抗性の直接的な原因ではないと考えました。この肝臓に、インスリン抵抗性の機序を解明するために行ったRNAシークエンス(遺伝子解析)を行ったところ、脂質代謝に関与する遺伝子が比較的多く含まれていることがわかりました。
夜行性のマウスにおいて血中遊離脂肪酸は、非活動時間帯のZeitgeber Time(ZT: マウスを明るい環境で 12 時間[明周期]、続いて暗い環境で 12 時間[暗周期]飼育し、明周期の開始時刻を ZT0、暗周期の開始時刻を ZT12 とした概日リズムでの時刻)4で最大となり、時間経過とともに低下し、活動時間帯のZT16で最小となりました。しかしながら、TG-Cマウスでは血中遊離脂肪酸の低下量が小さく、ZT16での血中遊離脂肪酸がコントロール群と比較して有意に高値でした。同様に血中トリグリセリドもZT12においてTG-Cマウスで有意に高値でした。
本来活動時間(摂食時間)帯での主たるエネルギー源は糖質ですが、非活動時間(非摂食時間)帯での主たるエネルギー源は脂質にシフトします。今回私たちの実験結果からは、TG-Cマウスでは非摂食時間帯における脂質利用障害があることが示唆されました。しかしながら、TG-Cマウスでは、脂質代謝のどこに障害が起こっているのか、またインスリン抵抗性との関連はどのようになっているのかなどまだまだ不明な点が多く、これらの点を少しでも明らかにした上で、成果を発表する予定としています。
体内時計と脂質代謝との関連性、その病的意義が明らかになれば、糖尿病のみならず、メタボリックシンドローム、動脈硬化を基盤とする心血管イベントの病態を全く新たな切り口から明らかにすることが出来るものと考えています。DBPを活性化するような低分子化合物や食品成分を見つけることが出来れば、糖尿病と合わせて脂質代謝も改善するような画期的な薬剤の開発に繋がる可能性があります。
体内時計によるマクロファージ(外界から侵入した病原体の貪食に関与する細胞の一つ)の機能調節に関する研究
現在社会においてアトピー性皮膚炎などのアレルギー疾患や膠原病などの自己免疫疾患が増加傾向です。そのような免疫システムの異常には人類の生活環境の変化が関与しているとも推測されていますが、因果関係については十分に解明されていません。一方、免疫システムにも前述の肝臓や膵β細胞と同様に体内時計が備わっており、コア時計遺伝子の発現異常により免疫異常をきたすことが報告されています (Caroline ES. et al, Nature communication, 2017)。そのような背景から近年のアレルギー疾患や自己免疫疾患の患者数の増加には、ライフスタイルの変化による体内時計の乱れも一因として考えられていますが、その機序については完全には解明されていません。そこで我々は “体内時計による免疫制御機構の解明”を次の実験テーマとして掲げ、研究を開始しています。この壮大なテーマに先鞭をつける研究として、我々は消化管マクロファージに着目しました。近年、消化管マクロファージは、潰瘍性大腸炎やクローン病といった炎症性腸疾患の発症に中心的な役割を担っていることが分かり、その重要が注目されている免疫細胞です(Bain CC, et al. Immunol Rev; 260: 102-17, 2014)。興味深いことに炎症性腸疾患は体内リズムの乱れで悪化すること(Calum CB. et al. Cellular Immunology 2014, Swanson GR et al. Gastroenterol Clin North Am. 2017)も知られており、炎症性腸疾患の病態にマクロファージの時計遺伝子が大きく関与しているのではないかと仮説を立てました。予備的な検討では、消化管マクロファージにもE4BP4をはじめとする時計遺伝子が高発現していることを確認しています。これまでにE4BP4を強発現するTGマウス(マクロファージ特異的E4BP4強発現マウス)を作製し、飼育中です。
今後の予定としては、このマウスを用いて炎症性腸疾患モデルを作製し、マクロファージの浸潤の程度や集簇するマクロファージのタイプを解析していきます。すでにDSS(デキストラン硫酸ナトリウム)を用いた炎症性腸疾患モデル作成技術は当研究室にて確立済で、さらにGentleMACS Dissociators (Miltenyi Biotec)を用いて消化管粘膜からマクロファージを単離する技術や、FACSAria™ III セルソーター(BD Biosciences)を用いて、マクロファージのサブクラスを正確に評価することにも成功しています。マクロファージはさまざまな刺激によって、炎症性マクロファージや抑制性マクロファージに分極すること(Shapouri-Moghaddam A et al. J Cell Physiol. 2018)が知られており、時計遺伝子はその分極化に関与している可能性も想定しています。
炎症性腸疾患と体内時計との間の詳細なメカニズムが明らかになれば、炎症性腸疾患の治療に対する科学的根拠に基づく生活指導や、体内時計を制御する食事や薬剤によって、炎症性腸疾患をはじめとした免疫疾患の治療に貢献できると考えています。
膵島生物学研究グループ
グループリーダー:
田部勝也
メンバー:
椎木幾久子、幡中雅行、近藤学、永尾優子、松永仁恵、Zou Meng
より良い医療の開発をめざし、研究活動を推進することは大学医学部の重要な使命です。
山口大学病態制御内科学講座では、糖尿病を主な対象として、様々な基礎的・臨床的研究に精力的に取り組んでいます。当グループではインスリンを分泌するβ細胞の生物学を中心に糖尿病の成因から病態、そして治療に関する研究を行なっており、その内容は遺伝子改変動物やiPS細胞を用いた分子医学的研究、希少な代謝・内分泌疾患の遺伝学的研究、ヒトを対象とした病態研究など多岐に亘っています。当グループの研究活動は、国内外から注目される重要な成果に繋がっています。
現在の研究テーマ
膵β細胞不全の成因と病態
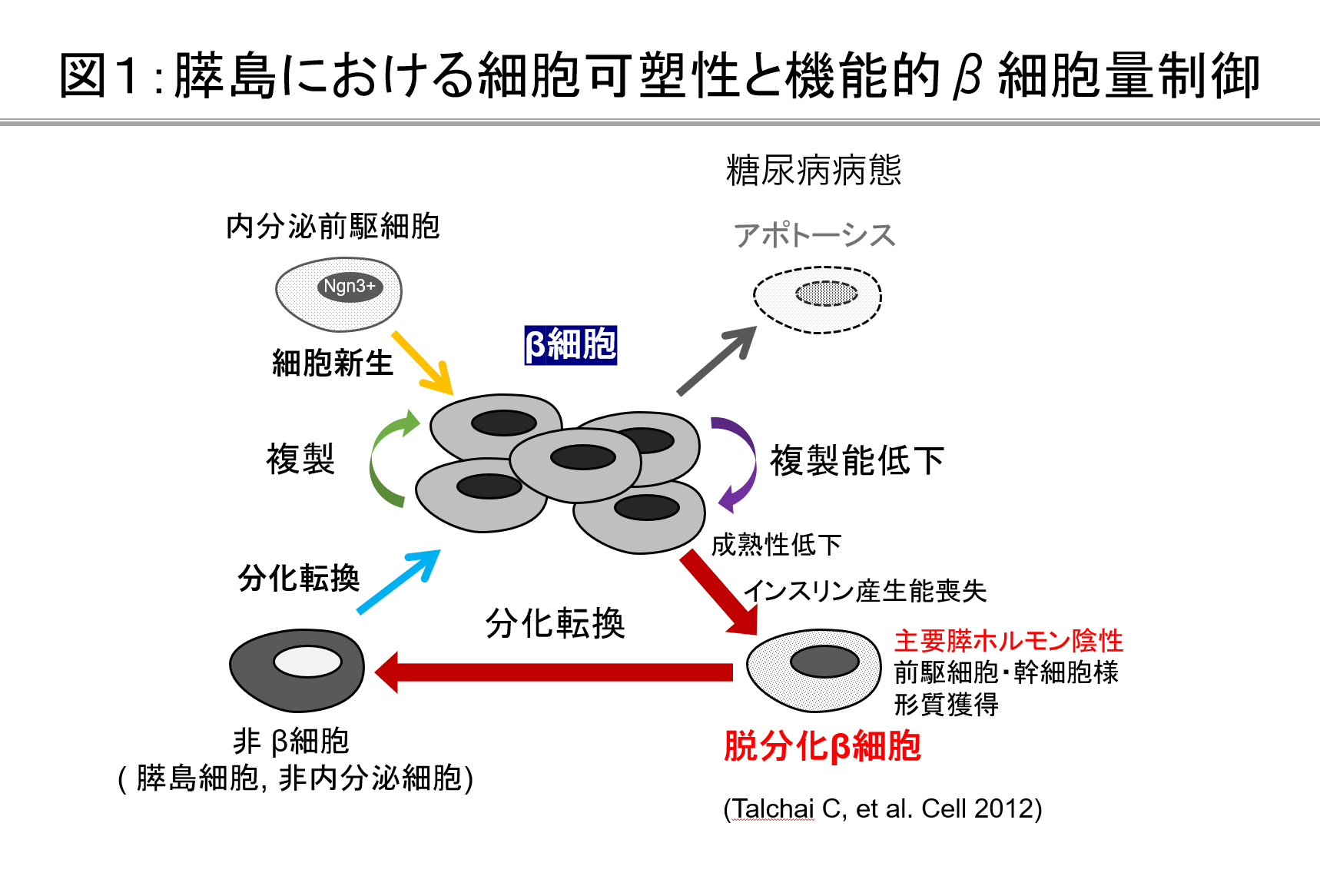
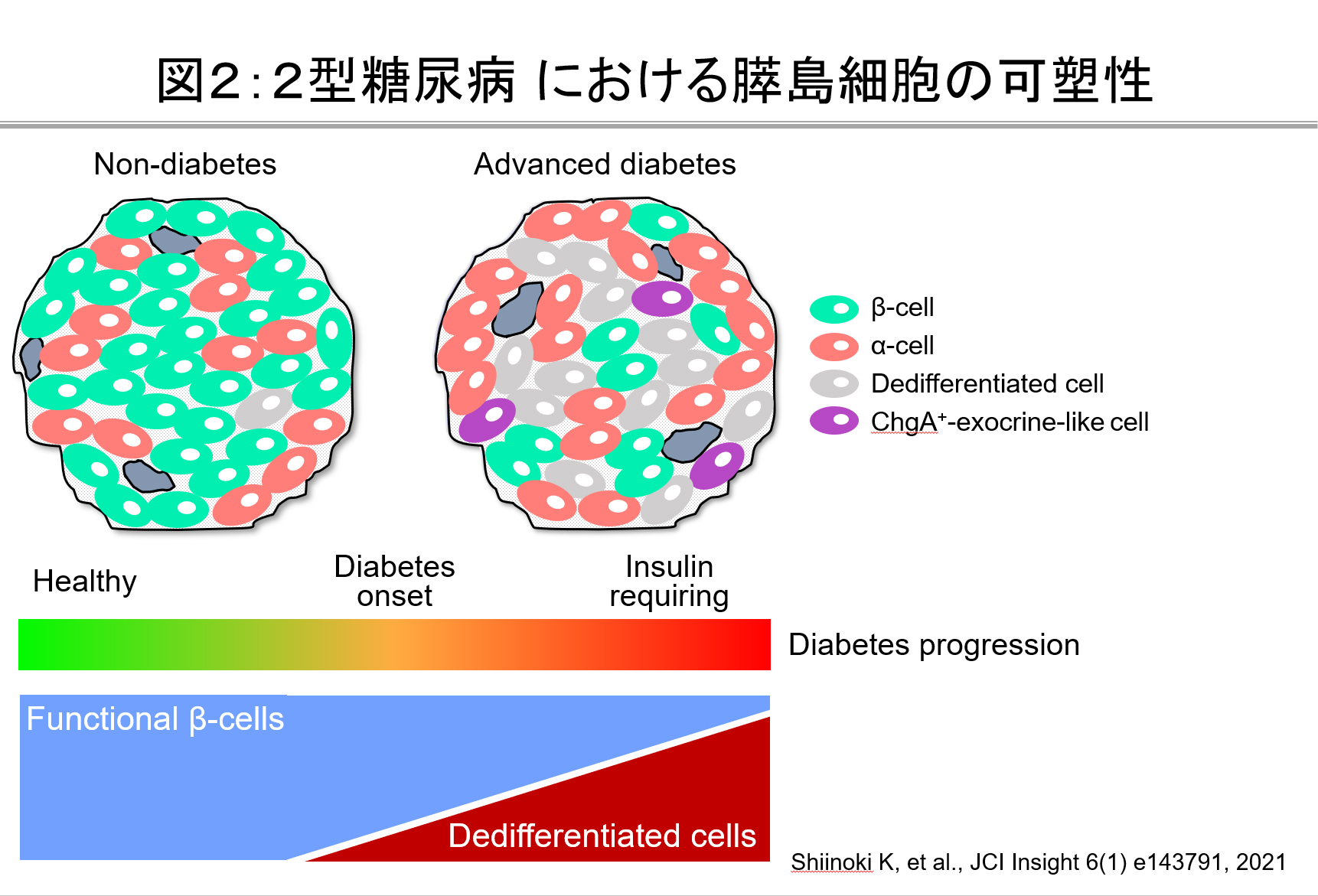
今から100年前にインスリンが発見され、治療への応用が始まりました。しかし、なぜ糖尿病でインスリン分泌能が失われるかということについて未だ十分に解明されていません。近年、遺伝子改変動物を用いた様々な検討よりβ細胞量の調節機構が紐解かれつつあります(図1)。我々の研究グループは、膵島の細胞可塑性に着目し、糖尿病における膵β細胞減少とインスリン分泌障害のメカニズム解明に取り組んでおり、2型糖尿病ではβ細胞が脱分化することで機能と量が失われることを報告してまいりました(図2)。現在、脱分化をきたす細胞内メカニズムと脱分化阻止に基づく糖尿病治療の研究を進めています。
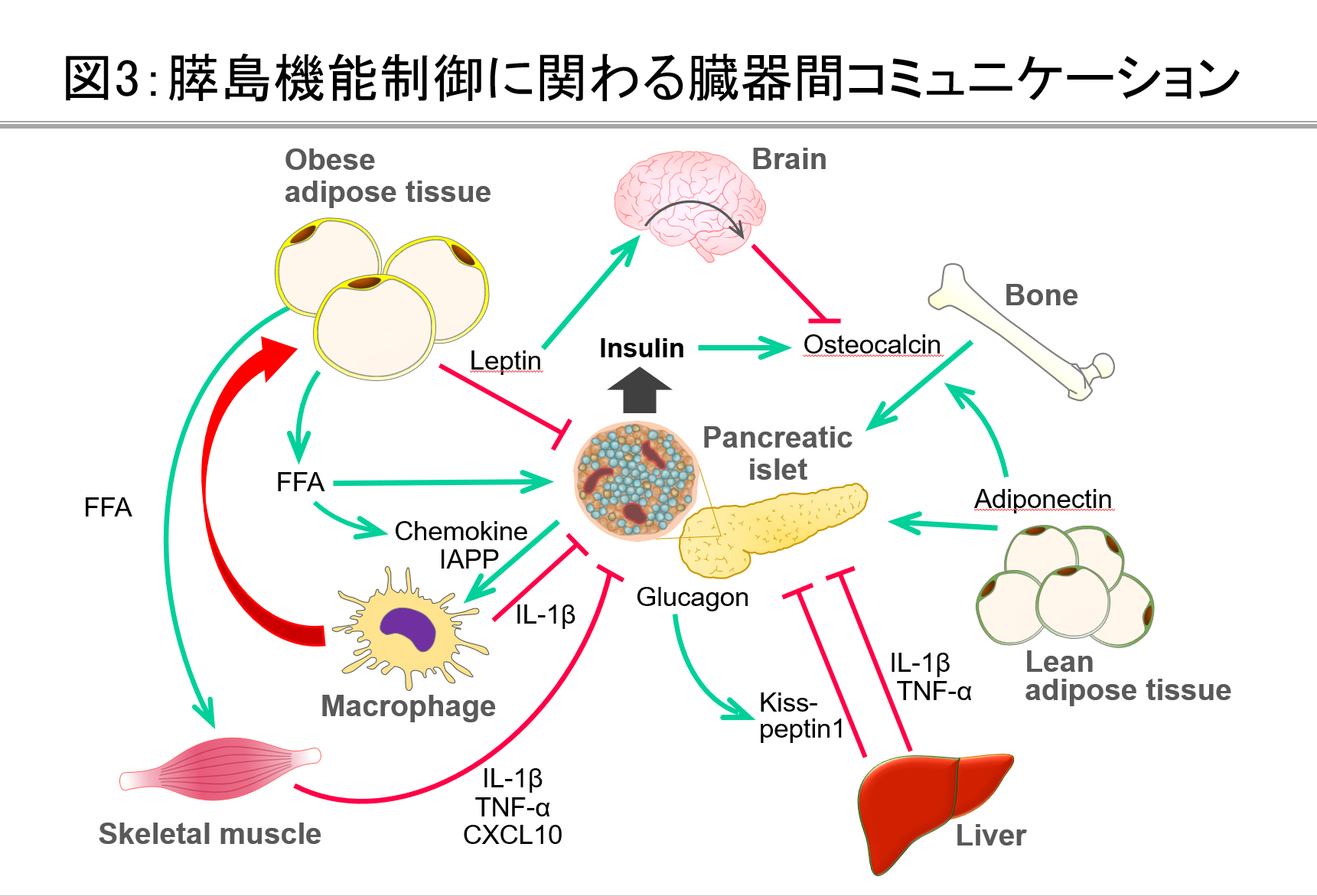
膵島機能を制御する臓器間コミュニケーション
生理的あるいは糖尿病病態において、膵島機能は様々な臓器間コミュニケーションによって制御されることが想定されています(図3)。当研究グループでは、栄養変化による肝臓や脂肪組織での代謝変化が、生体での代謝恒常性を維持するために中枢神経を介して膵島機能を調節する新しい生体メカニズムの解明に取り組んでいます。
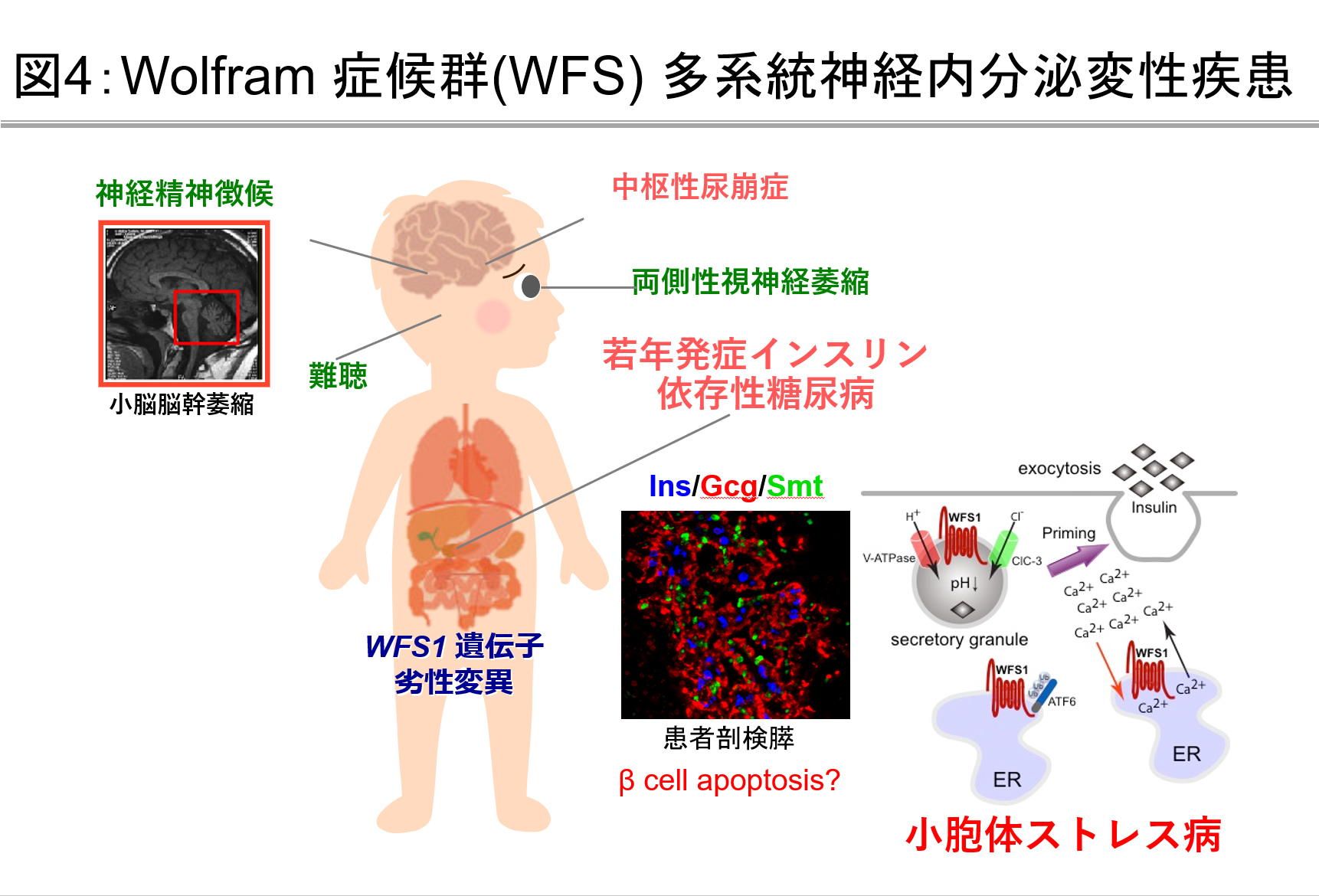
Wolfram症候群に関する調査研究
WFS1遺伝子異常によって症候性に糖尿病を発症するWolfram症候群の実態解明を行なっています。本疾患は難病指定(指定難病233)を受けているものの、希少疾患であることに加え、遺伝子診断体制が十分整備されていないこともあり、我が国における疾患実態は依然として多くの点で不明です。この病気は、若年発症インスリン依存性糖尿病に加え、両側視神経萎縮、中枢性尿崩症、さらに難聴、尿路異常、精神神経徴候を進行性に発症する他系統神経内分泌変性疾患です(図4)。臨床的には30歳未満で発症した糖尿病と両側視神経萎縮あるいはWFS1遺伝子異常によって診断されます。当グループでは、本疾患の患者調査と遺伝子診断を行い、診療のサポートをさせていただくとともに早期診断法開発を目指した研究に取り組んでいます。
Wolfram症候群の調査・遺伝子解析に関するお問い合わせは下記よりご連絡ください。
ktanabe@yamaguchi-u.ac.jp (田部勝也 宛)